Пищевые волокна — Клетчатка
Пищевые волокна — Клетчатка
Яндекс Картинки: > Пищевые волокна.
Яндекс Картинки: > Пищевые волокна — Клетчатка.
Пищевые волокна: новый взгляд на традиционные добавки. Популярно: > biokor.ru
http://www.rmj.ru/articles_1659.htm
В период внутриутробного развития желудочно-кишечный тракт плода стерилен. Во время родов новорожденный колонизирует ЖКТ через рот, проходя по родовым путям матери. Бактерии Е. Соli и стрептококки можно обнаружить в ЖКТ через несколько часов после рождения, причем они распространяются ото рта к анусу. Различные штаммы бифидобактерий и бактероиды появляются в ЖКТ спустя 10 дней после рождения.
Дети, рожденные путем кесарева сечения, имеют значительно более низкое содержание лактобактерий, чем появившиеся естественным путем [23].
Только у детей, находящихся на естественном вскармливании (грудное молоко), в микрофлоре кишечника преобладают бифидобактерии [10,30,37,31], с чем связывают меньший риск развития гастроинтестинальных инфекционных заболеваний. При искусственном вскармливании у ребенка не формируется преобладание какой-либо группы микроорганизмов [9].
Состав кишечной флоры ребенка после 2 лет практически не отличается от взрослого: более 400 видов бактерий, причем большинство — анаэробы, плохо поддающиеся культивированию. Все бактерии попадают в ЖКТ оральным путем. Плотность бактерий в желудке, тощей, подвздошной и ободочной кишках соответственно равна 1000, 10 000, 100 000 и 1 000 000 000 в 1 мл содержимого кишечника [6].
Олигосахариды, включая N-ацетилглюкозамин [22], глюкозу, галактозу, олигомеры фукозы или другие гликопротеины [16], которые в значительной пропорции составляют грудное молоко, являются специфичными факторами для роста бифидобактерий [33].
Лактулоза — синтетический дисахарид, не встречающийся в природе, в котором каждая молекула галактозы связана и-1,4-связью с молекулой фруктозы. Лактулоза попадает в толстый кишечник в неизмененном виде (лишь около 0,25-2,0% всасывается в неизмененном виде в тонкой кишке) и служит питательным субстратом для сахаролитических бактерий [25]. Лактулоза уже более 40 лет применяется в педиатрии для стимуляции роста лактобактерий у детей грудного возраста [28]. В процессе бактериального разложения лактулозы на короткоцепочечные жирные кислоты (молочная, уксусная, пропионовая, масляная) снижается рН содержимого толстой кишки. За счет этого же повышается осмотическое давление, ведущее к задержке жидкости в просвете кишки и усилению ее перистальтики [13, 25]. Использование лактулозы (Дюфалака) как источника углеводов и энергии приводит к увеличению бактериальной массы, и сопровождается активной утилизацией аммиака и азота аминокислот [34]. Эти изменения в конечном итоге ответственны за профилактический и терапевтический эффекты лактулозы: при запорах, портосистемной энцефалопатии, энтеритах (Salmonella enteritidis, Yersinia, Shigella), сахарном диабете [17] и других возможных показаниях.
Лактулоза – Дюфалак (торговое название) (Solvay Pharma)
Инулин — полисахарид, содержащийся в клубнях и корнях георгинов, артишоков и одуванчиков. Он представляет собой фруктозан, так как при его гидролизе образуется фруктоза. Было показано, что инулин помимо стимуляции роста и активности бифидо- и лактобактерий, повышает всасывание кальция в толстом кишечнике, т.е. снижает риск остеопороза, влияет на метаболизм липидов, уменьшая риск атеросклеротических изменений в сердечно-сосудистой системе и, возможно, предотвращая развитие сахарного диабета II типа, имеются предварительные данные о его антиканцерогенном эффекте [32, 36].
- 1. Ардатская М.Д. Дисбактериоз кишечника: понятие, диагностика, принципы лечебной коррекции.//СошШит теШсит. — 2008 — Т. 10. — № 8. — 2008 — с. 86-92
- 2. Ардатская М.Д. Синдром избыточного бактериального роста и нарушение процессов пищеварения и всасывания: патогенетическая нутрициологическая терапия. // Экспериментальная и клиническая гастроэнтерология. — 2009 -№ 6 — с. 84-96.
- 3. Ардатская М.Д., Минушкин О.Н., Прихно Н.И., Дубинин А.В.. Летучие жирные кислоты и их диагностическое и прогностическое значение в гастроэнтерологической клинике. // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. — 2000. — Т. 10. — № 5. — с. 63-70,
- (ещё > medzubr.ru)
Метаболические эффекты пищевых волокон. М.Д.Ардатская
- gastroportal.ru /
 версия для печати / »» Научные учреждения, школы »» Академическая школа-семинар им. А. М. Уголева «Современные проблемы физиологии и патологии пищеварения» »» Научные публикации
версия для печати / »» Научные учреждения, школы »» Академическая школа-семинар им. А. М. Уголева «Современные проблемы физиологии и патологии пищеварения» »» Научные публикации
- 64z.ru / pdf: Скачать & Смотреть «Метаболические эффекты пищевых волокон. Пути использования в клинической медицине» (?? Мб / pdf) Сайт: «Философия Здоровья» Оздоровительная продукция > Каталог 01 + Каталог 02
Современные принципы диагностики и фармакологической коррекции. М.Д.Ардатская, О.Н.Минушкин > www.gastroportal.ru
Кишечная микрофлора: взгляд изнутри. Инновационный сборник научных статей №2, 2013г. gastroportal.ru / ![]() версия для печати / mikroflora.pdf
версия для печати / mikroflora.pdf
Глава 1. ПРОБИОТИКИ
Глава 2. ПРЕБИОТИКИ
Глава 3. ПРОТИВОИНФЕКЦИОННАЯ АКТИВНОСТЬ ПРЕБИОТИКОВ И МЕТАБОЛИТНЫХ ПРОБИОТИКОВ
Глава 4. СПРАВОЧНАЯ ИНФОРМАЦИЯ О ДИССЕРТАЦИОННЫХ РАБОТАХ РФ ЗА 2000-2012 ГГ., ПОЛНОСТЬЮ ИЛИ ЧАСТИЧНО ПОСВЯЩЕННЫХ ВОПРОСАМ КИШЕЧНОЙ МИКРОФЛОРЫ
Скачать «Инновационный сборник научных статей «Кишечная микрофлора: взгляд изнутри. Выпуск №2, 2013г.» (3,9 Мб / pdf)
disbak.ru Метаболические эффекты пищевых волокон. М.Д.Ардатская Часть 1 + Часть 2
Дисбактериоз кишечника: понятие, диагностика, принципы лечебной коррекции. Ардатская М.Д. > www.disbak.ru
Пробиотики и пребиотики в регуляции кишечной микрофлоры / Микроэкология кишечника > www.rmj.ru
ЦЕНТР ЛЕЧЕНИЯ ДИСБАКТЕРИОЗОВ (ДИСБИОЗОВ)
Нормальная микрофлора + Таблица
Пищевые волокна — ПВ способствуют выведению ионов тяжелых металлов, свинца, никеля. Диссертация > tekhnosfera.com
Пшеничные отруби для похудения и очищения. > www.64z.ru/otrubi
ВОПРОСУ ОБ ЭНТЕРАЛЬНОМ ОБМЕНЕ БИОЭЛЕМЕНТОВ > cyberleninka.ru
Пектин и витамины: > vp.geotar.ru
Комплексные решения для медицинского образования от издательской группы «ГЭОТАР-Медиа»
и партнеров http://www.geotar.ru/
Загрядский Евгений Алексеевич: Кишечник, Волокна, Диета > doctor-zagriadskiy.ru
ПРОИЗВОДИТЕЛИ:
ООО «Рязанские просторы» http://www.inulin.ru/ || http://www.prostori.su/
Инсулин в бодибилдинге
Инсулин в бодибилдинге

Описание
Инсулин (от лат. insula — островок) является белково-пептидным гормоном, вырабатываемым β-клетками островков Лангерганса поджелудочной железы. В физиологических условиях в β-клетках инсулин образуется из препроинсулина — одноцепочечного белка-предшественника, состоящего из 110 аминокислотных остатков. После переноса через мембрану шероховатого эндоплазматического ретикулума от препроинсулина отщепляется сигнальный пептид из 24 аминокислот и образуется проинсулин. Длинная цепь проинсулина в аппарате Гольджи упаковывается в гранулы, где в результате гидролиза отщепляются четыре основных аминокислотных остатка с образованием инсулина и С-концевого пептида (физиологическая функция С-пептида неизвестна).
Молекула инсулина состоит из двух полипептидных цепей. Одна из них содержит 21 аминокислотный остаток (цепь А), вторая — 30 аминокислотных остатков (цепь В). Цепи соединены двумя дисульфидными мостиками. Третий дисульфидный мостик сформирован внутри цепи А. Общая молекулярная масса молекулы инсулина — около 5700. Аминокислотная последовательность инсулина считается консервативной. У большинства видов имеется один ген инсулина, кодирующий один белок. Исключение составляют крысы и мыши (имеют по два гена инсулина), у них образуются два инсулина, отличающиеся двумя аминокислотными остатками В-цепи.
Первичная структура инсулина у разных биологических видов, в т.ч. и у различных млекопитающих, несколько различается. Наиболее близкий к структуре инсулина человека — свиной инсулин, который отличается от человеческого одной аминокислотой (у него в цепи В вместо остатка аминокислоты треонина содержится остаток аланина). Бычий инсулин отличается от человеческого тремя аминокислотными остатками.
Историческая справка. В 1921 г. Фредерик Г. Бантинг и Чарльз Г. Бест, работая в лаборатории Джона Дж. Р. Маклеода в Университете Торонто, выделили из поджелудочной железы экстракт (как позже выяснилось, содержащий аморфный инсулин), который снижал уровень глюкозы в крови у собак с экспериментальным сахарным диабетом. В 1922 г. экстракт поджелудочной железы ввели первому пациенту — 14-летнему Леонарду Томпсону, больному диабетом, и тем самым спасли ему жизнь. В 1923 г. Джеймс Б. Коллип разработал методику очистки экстракта, выделяемого из поджелудочной железы, что в дальнейшем позволило получать из поджелудочных желез свиней и крупного рогатого скота активные экстракты, дающие воспроизводимые результаты. В 1923 г. Бантинг и Маклеод за открытие инсулина были удостоены Нобелевской премии по физиологии и медицине. В 1926 г. Дж. Абель и В. Дю-Виньо получили инсулин в кристаллическом виде. В 1939 г. инсулин был впервые одобрен FDA (Food and Drug Administration). Фредерик Сэнгер полностью расшифровал аминокислотную последовательность инсулина (1949–1954 гг.) В 1958 г. Сэнгеру была присуждена Нобелевская премия за работы по расшифровке структуры белков, особенно инсулина. В 1963 г. был синтезирован искусственный инсулин. Первый рекомбинантный человеческий инсулин был одобрен FDA в 1982 г. Аналог инсулина ультракороткого действия (инсулин лизпро) был одобрен FDA в 1996 г.
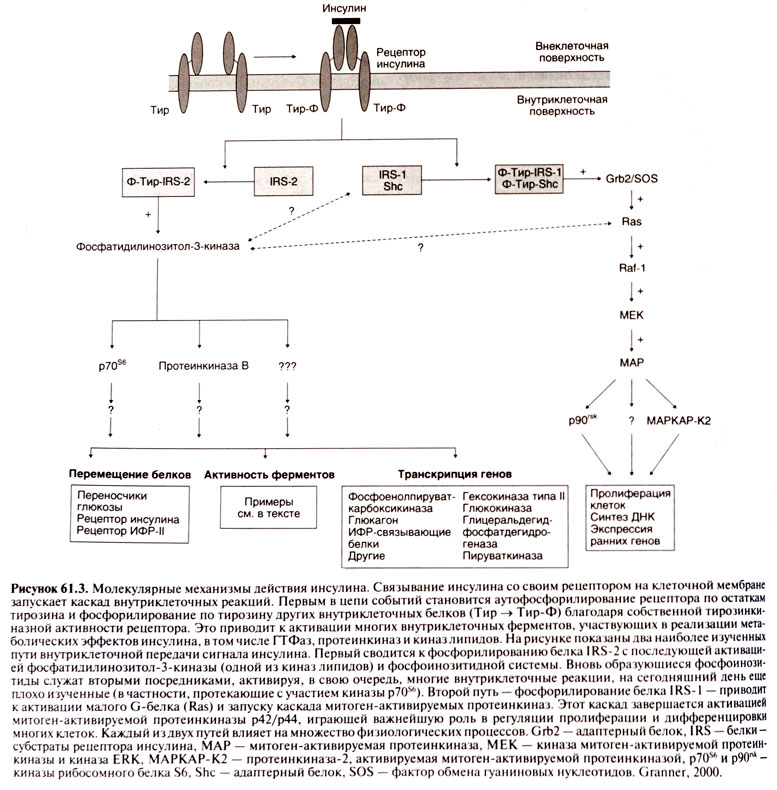
Механизм действия. В реализации эффектов инсулина ведущую роль играет его взаимодействие со специфическими рецепторами, локализующимися на плазматической мембране клетки, и образование инсулин-рецепторного комплекса. В комплексе с инсулиновым рецептором инсулин проникает в клетку, где оказывает влияние на процессы фосфорилирования клеточных белков и запускает многочисленные внутриклеточные реакции.
У млекопитающих инсулиновые рецепторы находятся практически на всех клетках — как на классических клетках-мишенях инсулина (гепатоциты, миоциты, липоциты), так и на клетках крови, головного мозга и половых желез. Число рецепторов на разных клетках колеблется от 40 (эритроциты) до 300 тыс. (гепатоциты и липоциты). Рецептор инсулина постоянно синтезируется и распадается, время его полужизни составляет 7–12 ч.
Рецептор инсулина представляет собой крупный трансмембранный гликопротеин, состоящий из двух α-субъединиц с молекулярной массой 135 кДа (каждая содержит 719 или 731 аминокислотный остаток в зависимости от сплайсинга мРНК) и двух β-субъединиц с молекулярной массой 95 кДа (по 620 аминокислотных остатков). Субъединицы соединены между собой дисульфидными связями и образуют гетеротетрамерную структуру β-α-α-β. Альфа-субъединицы расположены внеклеточно и содержат участки, связывающие инсулин, являясь распознающей частью рецептора. Бета-субъединицы образуют трансмембранный домен, обладают тирозинкиназной активностью и выполняют функцию преобразования сигнала. Связывание инсулина с α-субъединицами инсулинового рецептора приводит к стимуляции тирозинкиназной активности β-субъединиц путем аутофосфорилирования их тирозиновых остатков, происходит агрегация α,β-гетеродимеров и быстрая интернализация гормон-рецепторных комплексов. Активированный рецептор инсулина запускает каскад биохимических реакций, в т.ч. фосфорилирование других белков внутри клетки. Первой из таких реакций является фосфорилирование четырех белков, называемых субстратами рецептора инсулина (insulin receptor substrate), — IRS-1, IRS-2, IRS-3 и IRS-4.
Фармакологические эффекты инсулина. Инсулин оказывает влияние практически на все органы и ткани. Однако его главными мишенями служат печень, мышечная и жировая ткань.
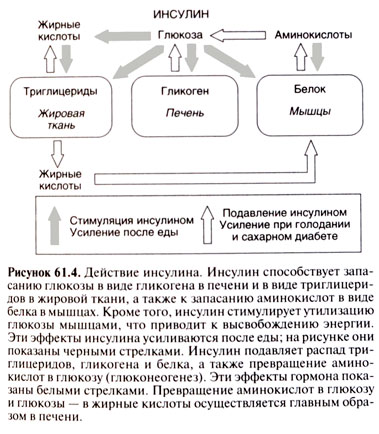
Эндогенный инсулин — важнейший регулятор углеводного обмена, экзогенный — специфическое сахаропонижающее средство. Влияние инсулина на углеводный обмен связано с тем, что он усиливает транспорт глюкозы через клеточную мембрану и ее утилизацию тканями, способствует превращению глюкозы в гликоген в печени. Инсулин, кроме того, угнетает эндогенную продукцию глюкозы за счет подавления гликогенолиза (расщепление гликогена до глюкозы) и глюконеогенеза (синтез глюкозы из неуглеводных источников — например из аминокислот, жирных кислот ). Помимо гипогликемического, инсулин оказывает ряд других эффектов.
Влияние инсулина на жировой обмен проявляется в угнетении липолиза, что приводит к снижению поступления свободных жирных кислот в кровоток. Инсулин препятствует образованию кетоновых тел в организме. Инсулин усиливает синтез жирных кислот и их последующую эстерификацию.
Инсулин участвует в метаболизме белков: увеличивает транспорт аминокислот через клеточную мембрану, стимулирует синтез пептидов, уменьшает расход тканями белка, тормозит превращение аминокислот в кетокислоты.
Действие инсулина сопровождается активацией или ингибированием ряда ферментов: стимулируются гликогенсинтетаза, пируват-дегидрогеназа, гексокиназа, ингибируются липазы (и гидролизующая липиды жировой ткани, и липопротеин-липаза, уменьшающая «помутнение» сыворотки крови после приема богатой жирами пищи).
В физиологической регуляции биосинтеза и секреции инсулина поджелудочной железой главную роль играет концентрация глюкозы в крови: при повышении ее содержания секреция инсулина усиливается, при снижении — замедляется. На секрецию инсулина, кроме глюкозы, оказывают влияние электролиты (особенно ионы Ca2+), аминокислоты (в т.ч. лейцин и аргинин), глюкагон, соматостатин.
Фармакокинетика. Препараты инсулина вводят п/к, в/м или в/в (в/в вводят только инсулины короткого действия и только при диабетической прекоме и коме). Нельзя вводить в/в суспензии инсулина. Температура вводимого инсулина должна соответствовать комнатной, т.к. холодный инсулин всасывается медленнее. Наиболее оптимальным способом для постоянной инсулинотерапии в клинической практике является п/к введение.
Полнота всасывания и начало эффекта инсулина зависят от места введения (обычно инсулин вводят в область живота, бедра, ягодицы, верхнюю часть рук), дозы (объема вводимого инсулина), концентрации инсулина в препарате и др.
Скорость всасывания инсулина в кровь из места п/к введения зависит от ряда факторов — типа инсулина, места инъекции, скорости местного кровотока, местной мышечной активности, количества вводимого инсулина (в одно место рекомендуется вводить не более 12–16 ЕД препарата). Быстрее всего инсулин поступает в кровь из подкожной клетчатки передней брюшной стенки, медленнее — из области плеча, передней поверхности бедра и еще медленнее — из подлопаточной области и ягодицы. Это связано со степенью васкуляризации подкожной жировой клетчатки перечисленных областей. Профиль действия инсулина подвержен значительным колебаниям как у различных людей, так и у одного и того же человека.
В крови инсулин связывается с альфа- и бета-глобулинами, в норме — 5–25%, но связывание может возрастать при лечении из-за появления сывороточных антител (выработка антител к экзогенному инсулину приводит к инсулинорезистентности; при использовании современных высокоочищенных препаратов инсулинорезистентность возникает редко). T1/2 из крови составляет менее 10 мин. Большая часть поступившего в кровоток инсулина подвергается протеолитическому распаду в печени и почках. Быстро выводится из организма почками (60%) и печенью (40%); менее 1,5% выводится с мочой в неизмененном виде.
Препараты инсулина, применяемые в настоящее время, отличаются по ряду признаков, в т.ч. по источнику происхождения, длительности действия, pH раствора (кислые и нейтральные), наличием консервантов (фенол, крезол, фенол-крезол, метилпарабен), концентрацией инсулина — 40, 80, 100, 200, 500 ЕД/мл.
Классификация. Инсулины обычно классифицируют по происхождению (бычий, свиной, человеческий, а также аналоги человеческого инсулина) и продолжительности действия.
В зависимости от источников получения различают инсулины животного происхождения (главным образом препараты свиного инсулина), препараты инсулина человека полусинтетические (получают из свиного инсулина методом ферментативной трансформации), препараты инсулина человека генно-инженерные (ДНК-рекомбинантные, получаемые методом генной инженерии).
Для медицинского применения инсулин ранее получали в основном из поджелудочных желез крупного рогатого скота, затем из поджелудочных желез свиней, учитывая, что свиной инсулин более близок к инсулину человека. Поскольку бычий инсулин, отличающийся от человеческого тремя аминокислотами, достаточно часто вызывает аллергические реакции, на сегодняшний день он практически не применяется. Свиной инсулин, отличающийся от человеческого одной аминокислотой, реже вызывает аллергические реакции. В лекарственных препаратах инсулина при недостаточной очистке могут присутствовать примеси (проинсулин, глюкагон, соматостатин, белки, полипептиды), способные вызывать различные побочные реакции. Современные технологии позволяют получать очищенные (монопиковые — хроматографически очищенные с выделением «пика» инсулина), высокоочищенные (монокомпонентные) и кристаллизованные препараты инсулина. Из препаратов инсулина животного происхождения предпочтение отдается монопиковому инсулину, получаемому из поджелудочной железы свиней. Получаемый методами генной инженерии инсулин полностью соответствует аминокислотному составу инсулина человека.
Активность инсулина определяют биологическим методом (по способности понижать содержание глюкозы в крови у кроликов) или физико-химическим методом (путем электрофореза на бумаге или методом хроматографии на бумаге). За одну единицу действия, или международную единицу, принимают активность 0,04082 мг кристаллического инсулина. Поджелудочная железа человека содержит до 8 мг инсулина (примерно 200 ЕД).
Препараты инсулина по длительности действия подразделяют на препараты короткого и ультракороткого действия — имитируют нормальную физиологическую секрецию инсулина поджелудочной железой в ответ на стимуляцию, препараты средней продолжительности и препараты длительного действия — имитируют базальную (фоновую) секрецию инсулина, а также комбинированные препараты (сочетают оба действия).
Различают следующие группы:
Инсулины ультракороткого действия (гипогликемический эффект развивается через 10–20 мин после п/к введения, пик действия достигается в среднем через 1–3 ч, длительность действия составляет 3–5 ч):
— инсулин лизпро (Хумалог);
— инсулин аспарт (НовоРапид Пенфилл, НовоРапид ФлексПен);
— инсулин глулизин (Апидра).
Инсулины короткого действия (начало действия обычно через 30–60 мин; максимум действия через 2–4 ч; продолжительность действия до 6–8 ч):
— инсулин растворимый [человеческий генно-инженерный] (Актрапид HМ, Генсулин Р, Ринсулин Р, Хумулин Регуляр);
— инсулин растворимый [человеческий полусинтетический] (Биогулин Р, Хумодар Р);
— инсулин растворимый [свиной монокомпонентный] (Актрапид МС, Монодар, Моносуинсулин МК).
Препараты инсулина пролонгированного действия — включают в себя препараты средней продолжительности действия и препараты длительного действия.
Инсулины средней длительности действия (начало через 1,5–2 ч; пик спустя 3–12 ч; продолжительность 8–12 ч):
— инсулин-изофан [человеческий генно-инженерный] (Биосулин Н, Гансулин Н, Генсулин Н, Инсуман Базал ГТ, Инсуран НПХ, Протафан НМ, Ринсулин НПХ, Хумулин НПХ);
— инсулин-изофан [человеческий полусинтетический] (Биогулин Н, Хумодар Б);
— инсулин-изофан [свиной монокомпонентный] (Монодар Б, Протафан МС);
— инсулин-цинк суспензия составная (Монотард МС).
Инсулины длительного действия (начало через 4–8 ч; пик спустя 8–18 ч; общая продолжительность 20–30 ч):
— инсулин гларгин (Лантус);
— инсулин детемир (Левемир Пенфилл, Левемир ФлексПен).
Препараты инсулина комбинированного действия (бифазные препараты) (гипогликемический эффект начинается через 30 мин после п/к введения, достигает максимума через 2–8 ч и продолжается до 18–20 ч):
— инсулин двухфазный [человеческий полусинтетический] (Биогулин 70/30, Хумодар K25);
— инсулин двухфазный [человеческий генно-инженерный] (Гансулин 30Р, Генсулин М 30, Инсуман Комб 25 ГТ, Микстард 30 НМ, Хумулин М3);
— инсулин аспарт двухфазный (НовоМикс 30 Пенфилл, НовоМикс 30 ФлексПен).
Инсулины ультракороткого действия — аналоги инсулина человека. Известно, что эндогенный инсулин в β-клетках поджелудочной железы, а также молекулы гормона в выпускаемых растворах инсулина короткого действия полимеризованы и представляют собой гексамеры. При п/к введении гексамерные формы всасываются медленно и пик концентрации гормона в крови, аналогичный таковому у здорового человека после еды, создать невозможно. Первым коротко действующим аналогом инсулина, который всасывается из подкожной клетчатки в 3 раза быстрее, чем человеческий инсулин, был инсулин лизпро. Инсулин лизпро — производное человеческого инсулина, полученное путем перестановки двух аминокислотных остатков в молекуле инсулина (лизин и пролин в положениях 28 и 29 В-цепи). Модификация молекулы инсулина нарушает образование гексамеров и обеспечивает быстрое поступление препарата в кровь. Почти сразу после п/к введения в тканях молекулы инсулина лизпро в виде гексамеров быстро диссоциируют на мономеры и поступают в кровь. Другой аналог инсулина — инсулин аспарт — был создан путем замены пролина в положении В28 на отрицательно заряженную аспарагиновую кислоту. Подобно инсулину лизпро, после п/к введения он также быстро распадается на мономеры. В инсулине глулизине замещение аминокислоты аспарагин человеческого инсулина в позиции В3 на лизин и лизина в позиции В29 на глутаминовую кислоту также способствует более быстрой абсорбции. Аналоги инсулина ультракороткого действия можно вводить непосредственно перед приемом пищи или после еды.
Инсулины короткого действия (их называют также растворимыми) — это растворы в буфере с нейтральными значениями pH (6,6–8,0). Они предназначены для подкожного, реже — внутримышечного введения. При необходимости их вводят также внутривенно. Они оказывают быстрое и относительно непродолжительное гипогликемическое действие. Эффект после подкожной инъекции наступает через 15–20 мин, достигает максимума через 2 ч; общая продолжительность действия составляет примерно 6 ч. Ими пользуются в основном в стационаре в ходе установления необходимой для больного дозы инсулина, а также когда требуется быстрый (ургентный) эффект — при диабетической коме и прекоме. При в/в введении T1/2 составляет 5 мин, поэтому при диабетической кетоацидотической коме инсулин вводят в/в капельно. Препараты инсулина короткого действия применяют также в качестве анаболических средств и назначают, как правило, в малых дозах (по 4–8 ЕД 1–2 раза в день).
Инсулины средней длительности действия хуже растворимы, медленнее всасываются из подкожной клетчатки, вследствие чего обладают более длительным эффектом. Продолжительное действие этих препаратов достигается наличием специального пролонгатора — протамина (изофан, протафан, базал) или цинка. Замедление всасывания инсулина в препаратах, содержащих инсулин цинк суспензию составную, обусловлено наличием кристаллов цинка. НПХ-инсулин (нейтральный протамин Хагедорна, или изофан) представляет собой суспензию, состоящую из инсулина и протамина (протамин — белок, изолированный из молок рыб) в стехиометрическом соотношении.
К инсулинам длительного действия относится инсулин гларгин — аналог человеческого инсулина, полученный методом ДНК-рекомбинантной технологии — первый препарат инсулина, который не имеет выраженного пика действия. Инсулин гларгин получают путем двух модификаций в молекуле инсулина: заменой в позиции 21 А-цепи (аспарагин) на глицин и присоединением двух остатков аргинина к С-концу В-цепи. Препарат представляет собой прозрачный раствор с рН 4. Кислый рН стабилизирует гексамеры инсулина и обеспечивает длительное и предсказуемое всасывание препарата из подкожной клетчатки. Однако из-за кислого рН инсулин гларгин нельзя комбинировать с инсулинами короткого действия, которые имеют нейтральный рН. Однократное введение инсулина гларгина обеспечивает 24-часовой беспиковый гликемический контроль. Большинство препаратов инсулина обладают т.н. «пиком» действия, отмечающимся, когда концентрация инсулина в крови достигает максимума. Инсулин гларгин не обладает выраженным пиком, поскольку высвобождается в кровоток с относительно постоянной скоростью.
Препараты инсулина пролонгированного действия выпускаются в различных лекарственных формах, оказывающих гипогликемический эффект разной продолжительности (от 10 до 36 ч). Пролонгированный эффект позволяет уменьшить число ежедневных инъекций. Выпускаются они обычно в виде суспензий, вводимых только подкожно или внутримышечно. При диабетической коме и прекоматозных состояниях пролонгированные препараты не применяют.
Комбинированные препараты инсулина представляют собой суспензии, состоящие из нейтрального растворимого инсулина короткого действия и инсулина-изофан (средней длительности действия) в определенных соотношениях. Такое сочетание инсулинов разной продолжительности действия в одном препарате позволяет избавить пациента от двух инъекций при раздельном использовании препаратов.
Показания. Основным показанием к применению инсулина является сахарный диабет типа 1, однако в определенных условиях его назначают и при сахарном диабете типа 2, в т.ч. при резистентности к пероральным гипогликемическим средствам, при тяжелых сопутствующих заболеваниях, при подготовке к оперативным вмешательствам, диабетической коме, при диабете у беременных. Инсулины короткого действия применяют не только при сахарном диабете, но и при некоторых других патологических процессах, например, при общем истощении (в качестве анаболического средства), фурункулезе, тиреотоксикозе, при заболеваниях желудка (атония, гастроптоз), хроническом гепатите, начальных формах цирроза печени, а также при некоторых психических заболеваниях (введение больших доз инсулина — т.н. гипогликемическая кома); иногда он используется как компонент «поляризующих» растворов, используемых для лечения острой сердечной недостаточности.
Инсулин является основным специфическим средством терапии сахарного диабета. Лечение сахарного диабета проводится по специально разработанным схемам с использованием препаратов инсулина разной продолжительности действия. Выбор препарата зависит от тяжести и особенностей течения заболевания, общего состояния больного и от скорости наступления и продолжительности сахароснижающего действия препарата.
Все препараты инсулина применяются при условии обязательного соблюдения диетического режима с ограничением энергетической ценности пищи (от 1700 до 3000 ккал).
При определении дозы инсулина руководствуются уровнем гликемии натощак и в течение суток, а также уровнем глюкозурии в течение суток. Окончательный подбор дозы проводится под контролем снижения гипергликемии, глюкозурии, а также общего состояния больного.
Противопоказания. Инсулин противопоказан при заболеваниях и состояниях, протекающих с гипогликемией (например инсулинома), при острых заболеваниях печени, поджелудочной железы, почек, язве желудка и двенадцатиперстной кишки, декомпенсированных пороках сердца, при острой коронарной недостаточности и некоторых других заболеваниях.
Применение при беременности. Основным медикаментозным методом лечения сахарного диабета во время беременности является инсулинотерапия, которая проводится под тщательным контролем. При сахарном диабете типа 1 продолжают лечение инсулином. При сахарном диабете типа 2 отменяют пероральные гипогликемические средства и проводят диетотерапию.
Гестационный сахарный диабет (диабет беременных) — это нарушение углеводного обмена, впервые возникшее во время беременности. Гестационный сахарный диабет сопровождается повышенным риском перинатальной смертности, частоты врожденных уродств, а также риском прогрессирования диабета через 5–10 лет после родов. Лечение гестационного сахарного диабета начинают с диетотерапии. При неэффективности диетотерапии применяют инсулин.
Для пациенток с ранее имевшимся или гестационным сахарным диабетом важно в течение всей беременности поддерживать адекватную регуляцию метаболических процессов. Потребность в инсулине может уменьшаться в I триместре беременности и увеличиваться во II–III триместрах. Во время родов и непосредственно после них потребность в инсулине может резко снизиться (возрастает риск развития гипогликемии). В этих условиях существенное значение имеет тщательный контроль содержания глюкозы в крови.
Инсулин не проникает через плацентарный барьер. Однако материнские IgG-антитела к инсулину проходят через плаценту и, вероятно, могут вызывать гипергликемию у плода за счет нейтрализации секретируемого у него инсулина. С другой стороны, нежелательная диссоциация комплексов инсулин–антитело может привести к гиперинсулинемии и гипогликемии у плода или новорожденного. Показано, что переход с препаратов бычьего/свиного инсулина на монокомпонентные препараты сопровождается снижением титра антител. В связи с этим при беременности рекомендуют использовать только препараты инсулина человека.
Аналоги инсулина (как и другие недавно разработанные средства) с осторожностью назначают при беременности, хотя достоверных данных о неблагоприятном воздействии нет. В соответствии с общепризнанными рекомендациями FDA (Food and Drug Administration), определяющими возможность применения ЛС при беременности, препараты инсулинов по действию на плод относятся к категории B (изучение репродукции на животных не выявило неблагоприятного действия на плод, а адекватных и строго контролируемых исследований у беременных женщин не проведено), либо к категории C (изучение репродукции на животных выявило неблагоприятное действие на плод, а адекватных и строго контролируемых исследований у беременных женщин не проведено, однако потенциальная польза, связанная с применением ЛС у беременных, может оправдывать его использование, несмотря на возможный риск). Так, инсулин лизпро относится к классу B, а инсулин аспарт и инсулин гларгин — к классу C.
Осложнения инсулинотерапии. Гипогликемия. Введение слишком высоких доз, а также недостаток поступления с пищей углеводов могут вызвать нежелательное гипогликемическое состояние, может развиться гипогликемическая кома с потерей сознания, судорогами и угнетением сердечной деятельности. Гипогликемия может также развиться в связи с действием дополнительных факторов, которые увеличивают чувствительность к инсулину (например надпочечниковая недостаточность, гипопитуитаризм) или увеличивают захват глюкозы тканями (физическая нагрузка).
К ранним симптомам гипогликемии, которые в значительной степени связаны с активацией симпатической нервной системы (адренергическая симптоматика) относятся тахикардия, холодный пот, дрожь, с активацией парасимпатической системы — сильный голод, тошнота, а также ощущение покалывания в области губ и языка. При первых признаках гипогликемии необходимо проведение срочных мероприятий: больной должен выпить сладкий чай или съесть несколько кусков сахара. При гипогликемической коме в вену вводят 40% раствор глюкозы в количестве 20–40 мл и более, пока больной не выйдет из коматозного состояния (обычно не более 100 мл). Снять гипогликемию можно также внутримышечным или подкожным введением глюкагона.
Увеличение массы тела при инсулинотерапии связано с устранением глюкозурии, увеличением реальной калорийности пищи, повышением аппетита и стимуляцией липогенеза под действием инсулина. При соблюдении принципов рационального питания этого побочного эффекта можно избежать.
Применение современных высокоочищенных препаратов гормона (особенно генно-инженерных препаратов человеческого инсулина) относительно редко приводит к развитию инсулинорезистентности и явлениям аллергии, однако такие случаи не исключены. Развитие острой аллергической реакции требует проведения немедленной десенсибилизирующей терапии и замены препарата. При развитии реакции на препараты бычьего/свиного инсулина следует заменить их препаратами инсулина человека. Местные и системные реакции (зуд, локальная или системная сыпь, образование подкожных узелков в месте инъекции) связаны с недостаточной очисткой инсулина от примесей или с применением бычьего или свиного инсулина, отличающихся по аминокислотной последовательности от человеческого.
Самые частые аллергические реакции — кожные, опосредуемые IgE-антителами. Изредка наблюдаются системные аллергические реакции, а также инсулинорезистентность, опосредуемые IgG-антителами.
Нарушение зрения. Преходящие нарушения рефракции глаза возникают в самом начале инсулинотерапии и проходят самостоятельно через 2–3 недели.
Отеки. В первые недели терапии возникают также преходящие отеки ног в связи с задержкой жидкости в организме, т.н. инсулиновые отеки.
К местным реакциям относят липодистрофию в месте повторных инъекций (редкое осложнение). Выделяют липоатрофию (исчезновение отложений подкожного жира) и липогипертрофию (увеличение отложения подкожного жира). Эти два состояния имеют разную природу. Липоатрофия — иммунологическая реакция, обусловленная главным образом введением плохо очищенных препаратов инсулина животного происхождения, в настоящее время практически не встречается. Липогипертрофия развивается и при использовании высокоочищенных препаратов человеческого инсулина и может возникать при нарушении техники введения (холодный препарат, попадание спирта под кожу), а также вследствие анаболического местного действия самого препарата. Липогипертрофия создает косметический дефект, что является проблемой для пациентов. Кроме того, из-за этого дефекта нарушается всасывание препарата. Для предупреждения развития липогипертрофии рекомендуется постоянно менять места инъекций в пределах одной области, оставляя расстояние между двумя проколами не менее 1 см.
Могут отмечаться такие местные реакции, как боль в месте введения.
Взаимодействие. Препараты инсулина можно комбинировать друг с другом. Многие ЛС могут вызывать гипо- или гипергликемию, либо изменять реакцию больного сахарным диабетом на лечение. Следует учитывать взаимодействие, возможное при одновременном применении инсулина с другими лекарственными средствами. Альфа-адреноблокаторы и бета-адреномиметики увеличивают секрецию эндогенного инсулина и усиливают действие препарата. Гипогликемическое действие инсулина усиливают пероральные гипогликемические средства, салицилаты, ингибиторы МАО (включая фуразолидон, прокарбазин, селегилин), ингибиторы АПФ, бромокриптин, октреотид, сульфаниламиды, анаболические стероиды (особенно оксандролон, метандиенон) и андрогены (повышают чувствительность тканей к инсулину и увеличивают резистентность тканей к глюкагону, что и приводит к гипогликемии, особенно в случае инсулинорезистентности; может понадобиться снижение дозы инсулина), аналоги соматостатина, гуанетидин, дизопирамид, клофибрат, кетоконазол, препараты лития, мебендазол, пентамидин, пиридоксин, пропоксифен, фенилбутазон, флуоксетин, теофиллин, фенфлурамин, препараты лития, препараты кальция, тетрациклины. Хлорохин, хинидин, хинин снижают деградацию инсулина и могут повышать концентрацию инсулина в крови и увеличивать риск гипогликемии.
Ингибиторы карбоангидразы (особенно ацетазоламид), стимулируя панкреатические β-клетки, способствуют высвобождению инсулина и повышают чувствительность рецепторов и тканей к инсулину; хотя одновременное использование этих ЛС с инсулином может повышать гипогликемическое действие, эффект может быть непредсказуемым.
Целый ряд ЛС вызывают гипергликемию у здоровых людей и усугубляют течение заболевания у больных сахарным диабетом. Гипогликемическое действие инсулина ослабляют: антиретровирусные ЛС, аспарагиназа, пероральные гормональные контрацептивы, глюкокортикоиды, диуретики (тиазидные, этакриновая кислота), гепарин, антагонисты Н2-рецепторов, сульфинпиразон, трициклические антидепрессанты, добутамин, изониазид, кальцитонин, ниацин, симпатомиметики, даназол, клонидин, БКК, диазоксид, морфин, фенитоин, соматотропин, тиреоидные гормоны, производные фенотиазина, никотин, этанол.
Глюкокортикоиды и эпинефрин оказывают на периферические ткани эффект, противоположный инсулину. Так, длительный прием системных глюкокортикоидов может вызывать гипергликемию, вплоть до сахарного диабета (стероидный диабет), который может наблюдаться примерно у 14% пациентов, принимающих системные кортикостероиды в течение нескольких недель или при длительном применении топических кортикостероидов. Некоторые ЛС ингибируют секрецию инсулина непосредственно (фенитоин, клонидин, дилтиазем) либо за счет уменьшения запасов калия (диуретики). Тиреоидные гормоны ускоряют метаболизм инсулина.
Наиболее значимо и часто влияют на действие инсулина бета-адреноблокаторы, пероральные гипогликемические средства, глюкокортикоиды, этанол, салицилаты.
Этанол ингибирует глюконеогенез в печени. Этот эффект наблюдается у всех людей. В связи с этим следует иметь в виду, что злоупотребление алкогольными напитками на фоне инсулинотерапии может привести к развитию тяжелого гипогликемического состояния. Небольшие количества алкоголя, принимаемого вместе с едой, обычно не вызывают проблем.
Бета-адреноблокаторы могут ингибировать секрецию инсулина, изменять метаболизм углеводов и увеличивать периферическую резистентность к действию инсулина, что приводит к гипергликемии. Однако они могут также ингибировать действие катехоламинов на глюконеогенез и гликогенолиз, что сопряжено с риском тяжелых гипогликемических реакций у больных сахарным диабетом. Более того, любой из бета-адреноблокаторов может маскировать адренергическую симптоматику, вызванную снижением уровня глюкозы в крови (в т.ч. тремор, сердцебиение), нарушая тем самым своевременное распознавание пациентом гипогликемии. Селективные бета1-адреноблокаторы (в т.ч. ацебутолол, атенолол, бетаксолол, бисопролол, метопролол) проявляют эти эффекты в меньшей степени.
НПВС и салицилаты в высоких дозах ингибируют синтез простагландина Е (который ингибирует секрецию эндогенного инсулина) и усиливают таким образом базальную секрецию инсулина, повышают чувствительность β-клеток поджелудочной железы к глюкозе; гипогликемический эффект при одновременном применении может потребовать корректировки дозы НПВС или салицилатов и/или инсулина, особенно при длительном совместном использовании.
В настоящее время выпускается значительное число инсулиновых препаратов, в т.ч. полученных из поджелудочных желез животных и синтезированных методами генной инженерии. Препаратами выбора для проведения инсулинотерапии являются генно-инженерные высокоочищенные человеческие инсулины, обладающие минимальной антигенностью (иммуногенной активностью), а также аналоги человеческого инсулина.
Препараты инсулина выпускаются в стеклянных флаконах, герметически укупоренных резиновыми пробками с алюминиевой обкаткой, в специальных т.н. инсулиновых шприцах или шприц-ручках. При использовании шприц-ручек препараты находятся в специальных флаконах-картриджах (пенфиллах).
Разрабатываются интраназальные формы инсулина и препараты инсулина для приема внутрь. При комбинации инсулина с детергентом и введении в виде аэрозоля на слизистую оболочку носа эффективный уровень в плазме достигается так же быстро, как и при в/в болюсном введении. Препараты инсулина для интраназального и перорального применения находятся на стадии разработки или проходят клинические испытания.
**
Инулин — типы
Инулин — типы
Источник:
Глутамат натрия (C5H8NO4Na, англ. MSG, moon. Aji no Moto®™ — эссенция вкуса, vetsin) — натриевая соль глутаминовой кислоты. Вещество, выделенное японским учёным в 1907 году. Официально внесён в международный список боевых отравляющих веществ — пищевых добавок под номером Е621.
Наряду с некоторыми другими аминокислотами, именно глутаминовая отвечает за ощущение «пятого вкуса» — умами (moon.うまみ). В Азии использовался с незапамятных времен ещё до своего синтеза в чистом виде, так как в больших количествах содержится в сое и некоторых морских водорослях, которые традиционно использовались в качестве приправ в этом регионе. А еще он в немалых количествах содержится в клейковине, а значит — всех мучных продуктах. Именно поэтому с хлебом еда вкуснее. Следовательно, глутамат — совсем не новая ГМО-хрень, как можно подумать, а вполне традиционная приправа.
Содержание |
Действие
Попадая на вкусовые сосочки, глутамат натрия стимулирует рецепторы, распознающие аминокислоты. Сам он имеет слабовыраженный, но специфический «мясной» вкус, особенно хорошо проявляющийся в сочетаниях, например с солёным.
Страхи
Считается, что:
- Глутамат натрия содержит дохуя натрия, который в больших количествах не очень-то и полезен. В действительности, натрия в глутамате (по массе) — 13,5%, а в той же поваренной соли — 40%. И если еще и принять во внимание, что глутамата добавляют заметно меньше, чем соли…
- Из-за глутамата часто невозможно прекратить жрать всякую фигню (как же хочется доесть эту пачку чипсов, а потом ещё одну, и ещё одну, и ещё…) — можно сказать про любую специю.
- Глутамат натрия, как и соль с сахаром, вызывает психологическое привыкание, то есть человек подсознательно будет предпочитать продукты с сабжем продуктам без него. Например, вместо нормальных макарон из твёрдых сортов пшеницы без ГН — бичпакет, напичканный ГН — аналогично, относится к любой специи.
- По обыкновению, добросовестный производитель глутаматом маскирует убожество изначального сырья, и тушёнка из выварки, перекрученных костных жил, мембран и сои будет на вкус не хуже, а то и лучше нормальной тушёнки из мяса — не только относится ко всем специям, но и попросту неправда, потому как никаким глутаматом не скрыть консистенцию продукта.
- При постоянном употреблении наступает расстройство вкуса, и оценить реальную кошерность пищи становится сложно — вы не поверите…
- Провоцирует приступы мигрени и аллергию — не доказано. Подробнее тут.
- По утверждению тех самых ученых, провоцирует у школоты повышенную активность (как и Яга), а у взрослых сонливость, что символизирует.
Если жрать глутамат ложками, от него портится зрение (со временем). У крыс: тут, тут и тут. Подобного действия на людей не обнаружено. Кроме того, паникеры от глутамата забывают добавить одну «малозначительную» деталь: несчастных крысок довели до слепоты откровенно лошадиными дозами — глутамат натрия составлял пятую часть всего их рациона, что в 20 раз выше допустимых норм. Так что, не жрите глутамат ложками. Хотя бы потому, что переглутамаченные продукты тупо не вкусны. Также следует помнить, что LD50 (полулетальная доза) глутамата натрия для крыс и мышей составляет 15-18 граммов на килограмм массы тела. Для сравнения, LD50 поваренной соли для крыс и мышей составляет 3-4 грамма.
Глутамат натрия и непримиримая борьба домохозяек с ним
Каждая домохозяйка знает, что глутамат натрия — это яд, хуже стрихнина, и продуктов, его содержащих, следует избегать. Доставляет читать их высеры на форумах в стиле «какашенции» о том, как тщательно они выбирают продукты в супермаркете по составу, остерегаясь глутамата. Типичные примеры высеровтут и тут.
Несмотря на то, что ученые давно определились с безвредностью (в разумных дозах) глутамата натрия, эта тема активно пиарилась и пиарится желтой прессойи в зомбоящике, чему тупые пёзды верят больше, чем результатам исследований, которых никогда не видели и видеть не хотят.
Пытаясь доказать вред глутамата, дальше всех зашли японские ученые, которые проводили опыты на крысах и даже сумели довести их до слепоты (глутамат в лошадиных дозах вреден для сетчатки глаза). Однако в тех опытах аж пятая часть рациона крыс состояла из чистого глутамата натрия. Местные же учёные, кручёные, верчёные, очевидно ознакомившись с доктринами пастафарианства, пытаются связать факт исчезновения тараканов в городах России с глутаматом натрия. Исчезновение тараканов замечено на просторах Руси семь лет назад, а именно тогда начался неконтролируемый бум его использования. Аргументация — тараканы такое есть не могут, пытались кормить насильно — плюются и ругаются матом. А яды последнего поколения, вызывающие «цепную реакцию» в рассаднике, как бы ни при чём.
Все сказанное выше можно отнести абсолютно к любому продукту: до сих пор не утихают споры насчет вреда соли, сахара, молока, мяса… Да чего угодно. Ибо если кормить крысу сплошь поваренной солью или сахаром, то у нее случится атеросклероз и диабет соответственно. Это безусловно указывает на вредность того, что крыса съела. Конечно, это не означает, что здоровый человек должен вообще ничего не есть, это лишь указание на то, что все хорошо в меру, даже вода и воздух. Другое дело, что «мера» — вещь ещё более спорная.
Список продуктов, содержащих глутамат в терминальных дозах
Для альтернативно одарённых химиков, любящих спать на лекции: глутаминовая кислота содержится в любой белковой пище. Причем вегетарианство не спасет — в растительной пище его бывает побольше, чем в мясе.
Сельдерей, сыры, и японские водоросли нори содержат сабж в таком количестве, что не прошли бы проверку в органах надзора, если бы их оценивали по тому же принципу, что и чипсы с дошираками. Да и соевый соус японцы с китайцами тоже не зря так любят.
Дополнительно добавляемый в качестве приправы глутамат натрия может составлять не более 1%, а на практике — раза в три меньше.
Как с этим бороться
А никак. И не надо. Аминокислоты, включая глутаминовую — важная часть рациона. Впрочем, эта аминокислота не является незаменимой. То есть естественным образом в разумных пределах синтезируется организмом человека. У нормальных людей глутамат частенько стоит на одной полке с прочими специями и без фанатизма добавляется в те блюда, в которых он уместен.
В качестве послесловия
|
[Я] убежден, что обильное употребление этого вещества есть результат сластолюбия, и соль была введена, главным образом, для возбуждения жажды, исключая, конечно, случаев, когда она необходима для сохранения мяса в далеких путешествиях или в местах, удаленных от рынков.Ведь мы не знаем ни одного животного, которое любило бы соль. |
| Джонатан Свифт, «Путешествия Гулливера» |
Ссылкота
- Умами (旨味) — вкус глутамата натрия
- «Огласите весь список, пожалуйста!»
- Сабж
- Рассказывает химик
- Про глутамат
- То что должен знать о сабже Пробудившийся член Седьмого Человечества. И твоя бабушка.
- Правильный e621





Свежие комментарии